La quiralidad y el efecto de los medicamentos
3 de marzo de 2021
|
La quiralidad es una propiedad de gran interés en la química orgánica e inorgánica y en la bioquímica, ya que la distribución espacial que adoptan los átomos que componen las moléculas puede afectar sus propiedades y también su reactividad.
Las moléculas quirales tienen también la propiedad de desviar o rotar el plano de luz polarizada en un cierto ángulo. Cuando rotan la luz hacia la derecha se les denomina dextrógiras y si desvían el plano de luz hacia la izquierda se les llama levógiras.
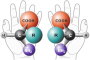
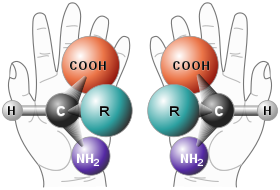
La actividad óptica es un fenómeno que ocurre en los enantiómeros, los cuales son una clase de estereoisómeros ópticos en los que en la pareja de compuestos, uno es la imagen especular del otro y no son superponibles.
Cada enantiómero de la pareja tiene en su nombre la letra correspondiente a su actividad óptica. En su nomenclatura se utilizan la letra R, del latín rectus, que significa derecho o la letra S, del latín sinister, que significa izquierdo.
Los compuestos enantiopuros son aquellos que poseen dentro de los límites de detección solo una de las dos moléculas quirales. En cambio, existen también mezclas racémicas, donde ambos estereoisómeros están presentes en un 50% cada uno.
Los enantiómeros de una sustancia tienen la misma estructura química e idénticas propiedades físico-químicas, pero las diferencias en la distribución espacial de los átomos alrededor de los centros estereogénicos o quirales hace que presenten actividad farmacológica y toxicológica distinta.
La mayoría de los fármacos procedentes de fuentes naturales son quirales y casi siempre se obtienen como un enantiómero y no como una mezcla racémica. En cambio, los que se producen por síntesis orgánica, por lo general se obtienen en forma de mezclas racémicas.
El ibuprofeno es un fármaco que contiene un centro de quiralidad y sólo el enantiómero S tiene actividad analgésica y antiinflamatoria. El enantiómero R es inactivo, por lo que la forma racémica es simplemente un medicamento que es 50% puro y contiene un 50% de “ingredientes inertes”, aunque en el organismo se convierte lentamente en la forma S, que es la activa, mediante reacciones catalizadas por enzimas del propio cuerpo.
Sintetizar y administrar un enantiómero que no sirve para determinada función no sólo es un desperdicio desde el punto de vista químico. Se conocen muchos ejemplos en que la presencia del enantiómero “ineficaz” en una mezcla racémica puede afectar la capacidad del organismo para utilizar al enantiómero “correcto”, o bien puede generar efectos famacológicos indeseables.
La separación de la mezcla de dos enantiómeros es un proceso difícil y costoso. Por esa razón reviste gran importancia al producir una sustancia medicamentosa, obtener directamente la forma quiral que cuenta con el efecto farmacológico deseado mediante la síntesis enantioselectiva de dicho enantiómero en lugar de la mezcla racémica.
La catálisis asimétrica para la síntesis industrial de productos farmacéuticos y otras sustancias biológicas activas desarrollada por los científicos William Knowles, Barry Sharpless y Ryoji Noyori, que en octubre de 2001 les hizo merecedores del premio Nobel en química, ha tenido un gran impacto en la obtención industrial de medicamentos en una sola de sus dos variantes enantioméricas posibles, ya sea dextrógira (R) o levógira (S).
Los medicamentos puros obtenidos por esta vía tienen la ventaja de disminuir en un 50% la cantidad de principio activo que se administra, así como los posibles efectos colaterales relacionados con la segunda forma enantiomérica. La cual no solo puede ser inactiva, sino que, en algunos casos, también puede ser contraproducente y tóxica.
Galería de Imágenes
Comentarios